Para que um medicamento chegue às mãos do consumidor, pelo menos dez anos de pesquisa e US$ 900 milhões foram gastos, por isso a indústria farmacêutica é considerada o setor que mais investe em inovação
Quando um consumidor recebe do balconista da farmácia uma caixa de medicamento, não imagina o longo ciclo que aquele produto atravessou até que pudesse ser vendido com segurança e eficácia garantidas. Esse caminho desconhecido pelos leigos se inicia com a descoberta de uma molécula promissora. Pesquisadores analisam doenças na tentativa de desvendar o que as causa.
A partir dessas descobertas, a indústria farmacêutica passa a estudar moléculas que poderão ser eficazes no combate a essas doenças, impedindo que elas avancem e até mesmo fazendo com que elas regridam. As moléculas podem ser sintéticas, quando produzidas em laboratórios, oriundas de componentes naturais que já existem ou produto de bioengenharia.
Nessa etapa inicial, as apostas são muito altas. Até o mais ousado jogador ficaria intimidado. A cada dez mil moléculas pesquisadas, apenas uma obtém resultados satisfatórios, que a permitirão se tornar um medicamento no futuro. Mas antes que isso ocorra, se passam, em média, dez anos de estudo. Somente para se obter autorização dos órgãos reguladores para testar uma molécula em seres humanos, são necessários, em média, seis anos de pesquisa.
Quando o laboratório farmacêutico recebe tal autorização, inicia-se outra bateria de testes. Nesse momento, as farmacêuticas recrutam voluntários portadores da doença pesquisada e também indivíduos sadios para efeito de comparação dos benefícios proporcionados pelo tratamento estudado. “Para angariar voluntários, os institutos de pesquisa costumam anunciar seus estudos em diversos meios de comunicação, como jornais, revistas, internet, mídias sociais, etc. Sociedades médicas e entidades de paciente, dependendo do caso, também são informadas”, enumera o presidente executivo da Associação da Indústria Farmacêutica de Pesquisa (Interfarma), Antônio Britto.
Os estudos com humanos são realizados em três fases. Na primeira delas, o foco principal está na segurança do tratamento. Como ele ainda não está assegurado, são recrutados poucos voluntários. Caso os resultados sejam positivos, inicia-se a segunda fase, feita com mais pessoas, com a intenção de analisar a eficácia e dosagem do novo medicamento. Por fim, a terceira fase é realizada com um número expressivo de pacientes voluntários e tem como objetivo comprovar a eficácia e a segurança do medicamento em uma grande variedade de pessoas.
Muitas vezes, o trabalho não termina aí. “Mesmo depois do medicamento ser aprovado, outras pesquisas podem continuar em andamento para definir novas indicações de uso ou aperfeiçoar a droga, aumentando sua eficácia e reduzindo suas reações adversas”, explica Britto.
Alto investimento
Obviamente, estudos tão específicos e longos apresentam um custo muito alto. Em média, o desenvolvimento de um novo medicamento demanda US$ 900 milhões de investimento de uma indústria farmacêutica. No mundo, o setor fatura US$ 1 trilhão mundialmente, mas cerca de US$ 120 bilhões a US$ 160 bilhões são investidos em pesquisa clínica.
São cifras como essas que colocam as empresas farmacêuticas como as maiores investidoras em Pesquisa & Desenvolvimento (P&D), antes mesmo de setores aclamados pela novidade, como tecnologia e automóveis. Enquanto a indústria farmacêutica investe algo entre 12% e 16% do total de faturamento, outras áreas aparecem bem atrás: indústria de softwares (9,5%), hardwares (7,9%), eletrônica (5,1%), automobilística (4,2%) e aeroespacial (4,1%).
Atualmente, boa parte dos gastos da indústria farmacêutica com P&D está focada na busca de novos tratamentos para doenças complexas, como o câncer e a esclerose múltipla. A grande promessa da área são os medicamentos biológicos, pois são capazes de agir praticamente de forma individualizada em determinados tratamentos, ampliando as possibilidades de cura e minimizando os efeitos colaterais. Estima-se que, até 2018, essa categoria represente 50% do faturamento dos cem medicamentos mais vendidos no mundo.
Entraves nacionais
Da média de US$ 140 bilhões gastos mundialmente com P&D, o Brasil recebe apenas US$ 300 milhões por ano. “É rigorosamente medíocre”, aponta Britto, ressaltando que os investimentos em pesquisa clínica no País só aumentarão quando dois grandes problemas forem solucionados. O primeiro deles é a relação entre a universidade e a iniciativa privada. “Os principais centros geradores de novas drogas no mundo são aqueles em que o governo apoia pesadamente a pesquisa básica; a indústria e a universidade trabalham de forma muito integrada.”
No Brasil, essas duas esferas têm resistência quanto a uma cooperação. A universidade resiste em trabalhar com a iniciativa privada, e a iniciativa privada resiste em assumir riscos. “É cultural. A nossa academia é voltada para estudos e pouco preparada para o mercado. Temos uma grande produção acadêmica e poucas patentes. Por questões ideológicas, não se busca ganhar dinheiro com as pesquisas”, acrescenta o presidente executivo do Sindicato da Indústria de Produtos Farmacêuticos no Estado de São Paulo (Sindusfarma), Nelson Mussolini.
De acordo com o executivo, não há motivos para temer a aproximação entre mercado e universidade. Outros setores, como a agricultura, mostraram que a parceria cria um cenário em que todos os personagens saem ganhando. “Dentro da Empresa Brasileira de Pesquisa Agropecuária (Embrapa), essa visão já existe. A colaboração entre as partes trouxe crescimento para a área. Os institutos de pesquisa ganham dinheiro vendendo inovação, podem contratar melhores pesquisadores e o setor avança com a adoção das tecnologias pesquisadas. É a roda da fortuna”, define.
|
Conheça todas as etapas da pesquisa clínica: Pré-Clínica: essa fase é composta por testes em laboratório (em situações artificiais e em animais) e sua conclusão pode durar anos. A meta principal dessa fase é verificar se a medicação em questão tem potencial para acabar com o câncer no ser humano, por exemplo. Clínica: essa etapa é composta por quatro fases sucessivas e necessárias para a aprovação da nova medicação dos órgãos de vigilância sanitária e posterior liberação e disponibilização para uso geral. Fase I: um estudo de fase I é a primeira etapa de testes em seres humanos de uma medicação cuja eficácia foi comprovada em animais na fase pré-clínica. Nessa fase, a medicação é testada em pequenos grupos (de 20 a 100) de voluntários sadios. Fase II – Estudo Terapêutico-Piloto: o número de pacientes que participa nessa fase é maior (de 100 a 200). Nessa fase, os voluntários já possuem a doença a ser tratada. Os estudos são realizados para obtenção de informações mais detalhadas sobre a segurança e avaliação da eficácia da medicação. Busca-se também a dose mais efetiva. Fase III: nesse estágio, o novo medicamento é comparado com o tratamento-padrão existente. O número de pacientes mínimos é de aproximadamente 800; esses estudos normalmente são internacionais, em vários centros (multicêntricos). Normalmente, são divididos em dois grupos: o grupo controle (recebe o tratamento-padrão) e o grupo investigacional (recebe a nova medicação). Alguns estudos da fase III envolvem a adição de uma nova medicação a uma já comprovada combinação de medicamentos para verificar se a combinação da nova droga com a droga do tratamento-padrão é mais efetiva. Nessa fase, há o estabelecimento do perfil terapêutico, como indicações, dose e via de administração, contraindicações, efeitos colaterais, medidas de precaução e demonstração de vantagem terapêutica (comparação com outros medicamentos). Esses estudam determinam o resultado do risco/benefício a curto e longo prazos e reações adversas mais frequentes. Fase IV: esses estudos são realizados para se confirmar que os resultados obtidos na fase anterior (fase III) são aplicáveis em uma grande parte da população doente. Essa fase se dá após a aprovação do medicamento onde ele já é comercializado. São estudos de vigilância pós-comercialização, para estabelecer o valor terapêutico, o surgimento de novas reações adversas ou confirmação das reações já conhecidas e estratégias de tratamento. Fonte: Agência Nacional de Vigilância Sanitária (Anvisa) |
Demora excessiva
O segundo obstáculo encontrado por quem tem interesse em investir em pesquisa pública no Brasil é o tempo de aprovação desses estudos. Enquanto os líderes mundiais – Estados Unidos, União Europeia, Coreia do Sul, Canadá, Japão e Austrália – avaliam um estudo clínico em até 90 dias, a média nacional é de 365 dias, prazo que, às vezes, é ainda maior, caso haja necessidade de ajuste nos protocolos.
A demora acaba por deixar o País fora dos estudos multicêntricos, que são os de maior relevância. De acordo com o Clinical Trials, o Brasil detém apenas 2% das 160 mil novas pesquisas sendo realizadas em 180 países. Um levantamento realizado pela Interfarma mostra que 16 estudos multicêntricos deixaram de ser realizados pelas farmacêuticas associadas nos primeiros meses do ano justamente pela morosidade das avaliações. Segundo o presidente do comitê gestor da Aliança Pesquisa Clínica Brasil (APCB), Vitor Harada, a situação real pode ser ainda bem pior. “Nós só conseguimos mensurar os estudos que tentamos submeter à aprovação, mas existem muitas outras pesquisas que as empresas nem cogitam em trazer para o Brasil.”
Quando um estudo é aprovado pelos órgãos nacionais, há outros impasses a ser driblados. De acordo com a Associação Brasileira de Organizações Representativas de Pesquisa Clínica (Abracro), entre janeiro de 2013 e março de 2014, sete empresas brasileiras do setor de pesquisa clínica fizeram 812 solicitações de licença de importação de materiais e medicamentos para desenvolvimento de estudos. O órgão demorou, em média, 13 dias para liberar os pedidos e, em alguns casos, concluiu os processos apenas após mais de três meses.
Órgãos públicos
O Brasil é o único país no mundo que exige uma aprovação tripla para cada estudo, que se inicia em um dos cerca de 700 Comitês de Ética em Pesquisa (CEPs), distribuídos em cada região, e se concretiza na Comissão Nacional de Ética em Pesquisa (Conep) e na Agência Nacional de Vigilância Sanitária (Anvisa). Essa é a maior razão para a demora nas aprovações de pesquisas clínicas.
“É fundamental mantermos um padrão elevado de análise ética das pesquisas clínicas submetidas à aprovação, mas não podemos demorar tanto para isso. Essa morosidade acaba fazendo com que muitos estudos deixem de ser feitos no País, o que dificulta o acesso dos pacientes às drogas experimentais e também prejudica o avanço da ciência no Brasil”, diz Britto.
Ciente dos prejuízos que o prazo alongado está trazendo para o setor de pesquisa no Brasil, a Conep iniciou uma série de melhorias no órgão e já vem colhendo resultados, conforme dados apresentados pelo coordenador da Conep, Jorge Venâncio, durante a 256.ª Reunião Ordinária do Conselho Nacional de Saúde.
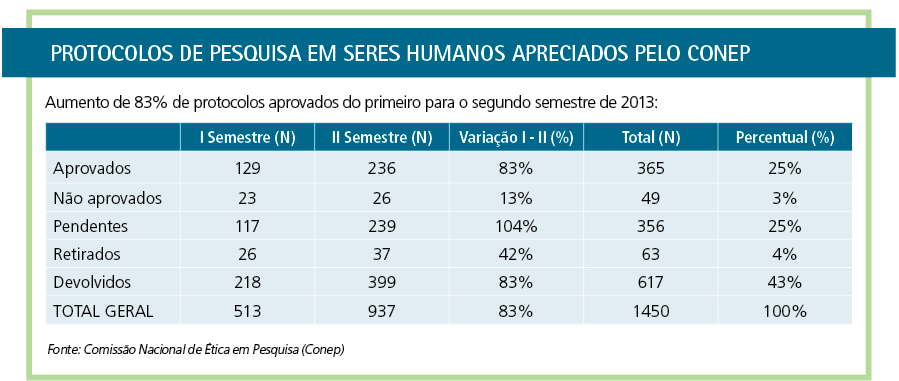
Entre as mudanças realizadas estão: acréscimo de 92% de assessores técnicos, aumento de 80% no número de relatores, colaboração de 29 relatores ad hoc convidados e ampliação das câmaras técnicas. O resultado foi um aumento de 83% de protocolos analisados, segundo dados divulgados em 2014.
Por Flávia Corbó