Agência reguladora esclarece que 'documentação da vacina russa ainda não é um pedido formal' de aprovação para as pesquisas clínicas da Sputnik V no Brasil
A Agência Nacional de Vigilância Sanitária (Anvisa) informou no último dia 29 que recebeu “documentos prévios que tratam da vacina russa Sputnik V contra a Covid-19”. O órgão regulador esclarece, no entanto, que esse “ainda não é um pedido formal” de aprovação para as pesquisas clínicas – testes em humanos – no Brasil.
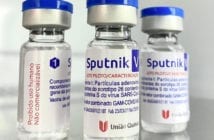
A Sputnik V, desenvolvida pelo Instituto Gamaleya, em Moscou, foi a primeira vacina registrada contra a Covid-19 no mundo.
No Brasil, o governo do Paraná já havia demonstrado interesse no imunizante e, o da Bahia, também assinou um acordo para conduzir testes clínicos de Fase III.
“Os documentos foram enviados pelo laboratório União Química com um pedido de avaliação prévia da documentação pela Anvisa, antes que o laboratório faça o pedido formal com todos os requisitos necessários”, informou a agência.
De acordo com a Anvisa, a documentação para solicitar a autorização de pesquisa clínica – Dossiê de Desenvolvimento Clínico de Medicamento (DDCM) – ainda não foi apresentada pela farmacêutica brasileira.
Além disso, a agência informou ainda que o laboratório também mostrou interesse em marcar uma reunião técnica antes de pedir formalmente a autorização dos estudos.
Pedido de uso emergencial
No último dia 27, a Rússia anunciou que pediu a aprovação do uso emergencial da Sputnik V à Organização Mundial de Saúde (OMS).
O RDIF, que coordena a produção da vacina, apresentou para a OMS os pedidos para registro incluídos na Lista de Uso de Emergência (EUL, na sigla em inglês) e também a pré-qualificação do imunizante – no entanto, os estudos ainda não foram finalizados.
O diretor do fundo, Kirill Dmitriev, comentou, então, o pedido à organização de saúde e afirmou que “permitirá que a Sputnik V seja incluída na lista de produtos médicos que atendem aos principais padrões de qualidade, segurança e eficácia”.
“Se um produto submetido para avaliação cumprir os critérios de listagem, a OMS publicará os resultados amplamente”, afirmou a entidade.
A organização informou também que “a duração do processo de listagem de uso de emergência depende da qualidade dos dados apresentados pelo fabricante da vacina e dos dados que atendem aos critérios da OMS”.
Fonte: G1
Foto: Shutterstock