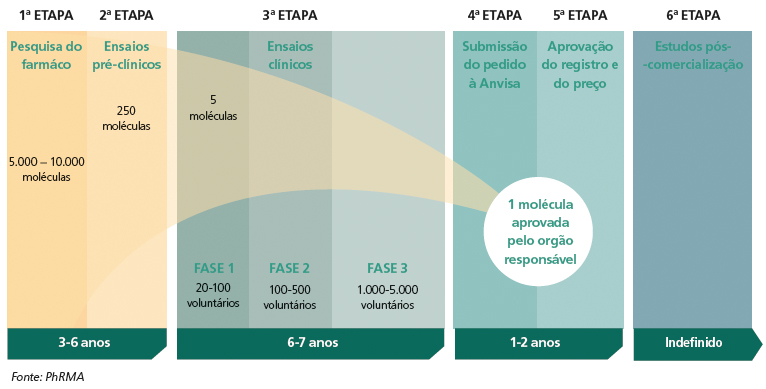
Antes que um medicamento seja registrado e possa ser comercializado como tratamento seguro e eficaz de uma enfermidade, um longo, complexo e dispendioso caminho é percorrido
Em 1975, quando algumas das mais tradicionais indústrias farmacêuticas já estavam em atividade, a produção de um novo medicamento custava cerca de US$ 138 milhões, segundo dados da Federação Internacional de Associações de Indústrias Farmacêuticas (IFPMA, na sigla em inglês). A cifra, um tanto volumosa, parece pequena perto dos valores investidos hoje em dia.
Com a evolução da ciência e o avanço da tecnologia, os processos utilizados pelas indústrias farmacêuticas tornaram-se mais complexos e sofisticados na tentativa de desenvolver tratamentos efetivos e seguros contra doenças antes sem controle. Como consequência, os custos aumentaram. A mesma IFPMA estima que, atualmente, apenas uma droga custe em torno de US$ 2,6 bilhões.
Além de elevar os custos, os avanços obtidos na área de pesquisa e desenvolvimento fizeram com que o tempo entre a descoberta de uma nova molécula até a comercialização de um medicamento se alongasse.
Hoje, são necessários, em média, dez anos até que um medicamento receba o registro das agências reguladoras e chegue às prateleiras das farmácias.
Início do caminho
Tudo começa ainda dentro do laboratório. Grupos de pesquisadores operam equipamentos sofisticados, que chegam a custar R$ 1 milhão, para realizar a modelagem de moléculas. Isto é, programas computacionais testam novas configurações de moléculas em busca de resultados inovadores.
“Já se tem conhecimento de que tal molécula é eficaz contra hipertensão, mas, de repente, se um átomo ou grupamento de átomos for trocado de lugar, a molécula se torna mais solúvel, aí é absorvida mais rápido pelo organismo e tem um tempo de ação mais curto”, exemplifica a diretora-geral do Centro Avançado de Estudo e Pesquisa (Caep), Dra. Ana Noboli.
Em seguida, as moléculas que chegaram a um resultado satisfatório avançam para a fase pré-clínica, em que os potenciais medicamentos são testados em animais – geralmente roedores, caninos e primatas.
Nessa etapa, são avaliadas a toxicidade e a terotogênese (risco de produzir dano ao embrião ou feto durante a gravidez) do fármaco. “É necessária uma série de processos para que se consiga entender como tal molécula vai funcionar em um modelo animal. São avaliações físicas, químicas e biológicas para chegar num modelo que se entende ser seguro e promissor”, explica a presidente executiva da Sociedade Brasileira de Profissionais em Pesquisa Clínica (SBPPC), Dra. Greyce Lousana.
No entanto, apenas 12% das moléculas pesquisadas recebem aval para avançar à etapa de pesquisa clínica, em que o composto começa a ser ministrado em pacientes como droga experimental.
Um exemplo dado pela Associação da Indústria Farmacêutica de Pesquisa (Interfarma) ilustra bem o nível de risco a que estão submetidas as empresas de inovação: entre 1998 e 2014, das 386 pesquisas contra mal de Alzheimer, melanoma e câncer de pulmões apenas 14 estudos acabaram sendo aprovados para avançar como pesquisa clínica.
A boa notícia é que mesmo o estudo de um fármaco não bem-sucedido pode trazer benefícios. “As descobertas do processo de pesquisa beneficiam a ciência do setor em busca de novas soluções contra doenças e em benefício da saúde”, afirma o presidente executivo da Interfarma, Antônio Britto.
|
A PESQUISA CLÍNICA ATUALMENTE Mais de sete mil medicamentos estão em desenvolvimento no mundo todo: • 1.256 voltados para doenças infecciosas; • 1.813 para câncer; • 1.120 para doenças imunológicas; • 1.329 para doenças neurológias; • 599 para doenças cardiovasculares; • 159 para o HIV/AIDS; • 475 para diabetes; • 551 para transtornos mentais. Fonte: Federação Internacional de Associações de Indústrias Farmacêuticas (IFPMA, na sigla em inglês) – Facts and Figures 2015 |
Pesquisa clínica
Os estudos de potenciais medicamentos em seres humanos envolvem um novo, longo e custoso processo, dividido em quatro fases. A primeira delas, chamada de Fase I, avalia o perfil farmacocinético do fármaco em um número pequeno de voluntários saudáveis.
“A ideia é conhecer o medicamento. Se ele tem absorção rápida, quanto é absorvido, quais são os metabólicos que ele vai gerar, se são tóxicos e ativos, como serão eliminados pelo corpo, além de ser avaliada a dose mais adequada”, detalha a Dra. Ana.
Esse estágio inicial da pesquisa clínica oferece aos profissionais subsídios e informações necessárias para partir para a Fase II do estudo, em que é utilizado um grupo um pouco maior de voluntários (100 e 200 pessoas) com a patologia-alvo do fármaco.
A intenção dessa etapa é delinear os critérios que servirão de base para a terceira fase da pesquisa, em que a eficácia e segurança do medicamento são testadas. A taxa de resposta para um estudo Fase II precisa ser igual ou maior que a obtida em um tratamento já existente no mercado para que se passe para um estudo Fase III.
Nessa última etapa, é preciso testar o tratamento em centenas de pacientes, de diversos países, para garantir a eficácia e a segurança em grupos distintos de pessoas. É nesse momento que se estabelece o perfil terapêutico.
Todo esse processo de pesquisa clínica, por ser minucioso e preciso, pode levar entre seis e sete anos para ser finalizado. O nível de exigência é tamanho que, desde a fase inicial do estudo da molécula até o término dos testes em humanos, apenas uma em cada dez mil moléculas pesquisadas consegue se tornar um medicamento eficaz e seguro o suficiente para ser aprovado e comercializado.
Além do tempo requerido no processo, são necessários profissionais com conhecimentos muito específicos e aprofundados em diversas áreas das ciências médicas. É devido a essa estrutura complexa e avaliações rigorosas que os medicamentos chegam a custar até US$ 2,6 bilhões para ser desenvolvidos.
|
O DESENVOLVIMENTO DE UM MEDICAMENTO |
Obstáculos burocráticos
Uma vez finalizada a Fase III, ainda é preciso enfrentar um processo de registro junto às agências reguladoras que, com base em um completo dossiê técnico-científico, avaliam o produto do ponto de vista sanitário.
No Brasil, essa etapa costuma ser vagarosa. De acordo com a Dra. Greyce, da SBPPC, na teoria, os prazos requeridos pelas agências reguladores no Brasil são aceitáveis.
“O que acontece é que, em muitos casos, os prazos não são cumpridos. Se fossem seguidos, seríamos um país muito mais competitivo”, comenta.
Segundo a Interfarma, um dos agentes causadores desse atraso é a exigência no Brasil de uma dupla validação do sistema Comitê de Ética em Pesquisa e Comissão Nacional de Ética em Pesquisa (CEP/CONEP), responsável pela análise ética dos pedidos de estudos clínicos.
“Levam-se em média 12 meses, o dobro da média mundial. Defendemos que, para que o País se torne inovador no setor farmacêutico, é preciso mais agilidade”, afirma Britto.
Ainda segundo o executivo, outro grande obstáculo para a inovação e a pesquisa clínica no Brasil tem sido a resistência das universidades em trabalharem com a iniciativa privada, enquanto a iniciativa privada resiste em assumir o risco da inovação.
Pós-registro
As exigências quanto à segurança e eficácia são tão firmes que continuam mesmo após a liberação do registro do medicamento. Ao longo dos anos que sucedem o início da comercialização do fármaco, é executada a Fase IV da pesquisa clínica.
Esse estágio tem a missão de confirmar se os resultados obtidos na Fase III, ocorrida em ambiente controlado, são os mesmos em uma grande parte de população doente ou se são observadas novas reações adversas.